Содержание
- Иммунные клетки вырабатывают интерферон в ответ на инфицирование бактерией Хеликобактер
- Хеликобактер защищается от иммунной системы, отбирая холестерин у эпителиальных клеток желудка
- Введение холестерина обманывает Хеликобактер и восстанавливает защитный ответ интерферона, но усиливает воспаление
- Хеликобактер подавляет синтез интерферона, стимулированный пробиотиками
- Лечение Хеликобактер пилори рекомбинантным интерфероном-α2b
- Вклад интерферона-гамма в защиту от инфекции Хеликобактер пилори
- Вывод
- Источники
Хеликобактер пилори — бактерия, которая является основной причиной хронического гастрита, язвенной болезни, рака желудка. Примерно половина населения мира инфицирована этой бактерией, которая эволюционировала вместе с человеком последние 30 тысяч лет. За это время бактерия выработала многочисленные механизмы защиты от иммунной системы, один из которых — блокирование сигналов интерферона.
Иммунные клетки вырабатывают интерферон в ответ на инфицирование бактерией Хеликобактер
Этот механизм детально исследовала международная группа ученых в 2022 году:
- Сначала иммунные клетки моноциты поглощают бактерии. В процессе уничтожения бактерий моноциты обнаруживают чужеродную генетическую информацию — РНК – и стимулируют клетки вырабатывать интерферон I типа (ИФН-1).
- Молекулы интерферона привлекают в очаг заражения другие иммунные клетки — лимфоциты, дендритные клетки.
- ИФН-1 стимулирует выработку белков, вызывающих воспалительную реакцию, чтобы справиться с бактерией.
Хеликобактер защищается от иммунной системы, отбирая холестерин у эпителиальных клеток желудка
Чтобы защититься от сильного воспаления и избежать ощутимой реакции иммунной системы, бактерия Хеликобактер лишает эпителиальные клетки желудка возможности принять сигнал интерферона и выработать антибактериальные белки.
Этот защитный механизм бактерии открыт немецкими учеными в 2018 году. Ученые обнаружили, что Хеликобактер извлекает холестерин из мембран эпителиальных клеток желудка. В результате нарушается геометрия мембранных белков, улавливающих молекулы ИФН. Сама же бактерия использует холестерин для размножения — ее клеточная мембрана также состоит из холестерина, который она сама производить не способна.
В результате работы защитного механизма в очаге поражения образуется область пониженного воспаления, меньшего количества иммунных клеток и белков антибактериальной защиты. В этой области и живут бактерии. Причем в соседних с ней областях со здоровым эпителием, наоборот, наблюдается повышенное воспаление и высокая концентрация провоспалительных белковых молекул и иммунных клеток.
Введение холестерина обманывает Хеликобактер и восстанавливает защитный ответ интерферона, но усиливает воспаление
Ученые продолжили исследовать влияние холестерина и ввели в инфицированные участки водорастворимый холестерин. В результате бактерии переключились на этот внешний источник холестерина, а мембраны эпителиальных клеток желудка восстановились, стали восприимчивы к молекулам интерферона и начали вырабатывать высокоэффективные белки, уничтожающие Хеликобактер.
Более раннее исследование этой же группы ученых продемонстрировало, как диета, богатая холестерином, способствует снижению численности Хеликобактер. Ученые держали две группы мышей, зараженных бактерией, на различных диетах. Одна группа употребляла только продукты без холестерина. Вторая группа — с 2%-ым содержанием холестерина. Через 25 недель у мышей, употреблявших холестерин, уровень Хеликобактер был на 95% ниже, чем у мышей на безхолестериновой диете. Однако у мышей в группе холестерина был значительно более высокий уровень воспаления. Ученые объясняют такой эффект привлечением в пораженные области дополнительных иммунных клеток и выработкой белков антибактериальной защиты, которые, с одной стороны, значительно снижают численность Хеликобактер, но, с другой стороны, усиливают воспалительные процессы.
В этом же исследовании ученые наблюдали миграцию Хеликобактер в области с более высокой концентрацией холестерина. Для эксперимента использовались соединенные между собой пробирки. В одной – культура бактерий. В других — раствор холестерина в разной концентрации. Было установлено, что Хеликобактер улавливает концентрации холестерина в 250 раз ниже, чем в крови, и перемещается к источнику.
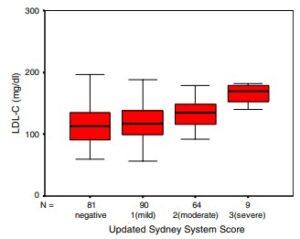
Основываясь на этих результатах, ученые рекомендуют диету с пониженным содержанием холестерина. В своем решении специалисты ссылаются на исследование турецких ученых, которые обнаружили тяжелые формы гастрита у людей с высоким уровнем липопротеинов низкой плотности и зараженных Хеликобактером:
Источник изображения: https://link.springer.com/article/10.1007/s10620-008-0391-y
Хеликобактер подавляет синтез интерферона, стимулированный пробиотиками
Другой механизм защиты Хеликобактера от иммунной системы связан с синтезом молекул интерферона, а не с передачей сигналов, как в предыдущем случае.
Датские ученые обнаружили, что пробиотические бактерии стимулируют иммунные клетки вырабатывать интерферон-бета (ИФН-β), а также проанализировали 43 штамма пробиотиков, выявив самый эффективный штамм. Детали исследования – в статье «Как правильно выбрать пробиотик».
Однако Хеликобактер пилори вырабатывает специальный токсин VacA, который блокирует выработку ИФН-β, стимулируемую пробиотиками, и тем самым препятствует запуску адаптивного иммунитета. Этот механизм был открыт в 2013 году международной группой ученых. Подробнее о токсине VacA – в статье «Как Хеликобактер мешает пробиотикам стимулировать синтез ИФН-β».
Ученых заинтересовали противоречивые данные более ранних клинических исследований. В некоторых исследованиях пробиотические бактерии уменьшали численность Хеликобактер пилори и снижали побочные эффекты при стандартном лечении антибиотиками. Однако другое исследование на 62 пациентах с пептическими язвами и язвенными рубцами не выявило положительного влияния пробиотиков.
В результате исследования было сделано несколько важных открытий:
- Стимуляция иммунных клеток пробиотиками увеличивает синтез ИФН-β в 400 раз.
- Добавление Хеликобактер пилори к пробиотическим бактериям в концентрации 1:1 блокирует выработку ИФН-β.
- Негативное влияние Хеликобактера нивелируется предварительной обработкой пробиотиком иммунных клеток в течение 3,5 часов.
- Более высокие концентрации пробиотических бактерий немного увеличивают синтез ИФН-β. И только начиная с концентрации 16:1 негативное влияние Хеликобактер пилори на выработку интерферона-бета становится незначительным.
- Блокировка синтеза ИФН-β связана не с действием отдельно взятых бактерий Хеликобактер, а с выработкой ими специальных веществ. Токсин VacA, вырабатываемый Хеликобактером, способствует образованию в клетках кислых вакуолей и нарушению структуры клеточных мембран. Этот токсин открыт в 2000 году как фактор, ухудшающий защитные свойства слизи, выстилающей желудок. В настоящем исследовании ученые проверили свое предположение с помощью генно-модифицированной бактерии Хеликобактер, лишенной способности вырабатывать токсин VacA. Генно-модифицированная бактерия не влияла на синтез интерферона-бета, стимулированный пробиотиком.
Лечение Хеликобактер пилори рекомбинантным интерфероном-α2b
Хеликобактер подавляет синтез интерферона и ухудшает передачу его сигналов. Поэтому препараты интерферона могут применяться для лечения гастрита и язвенной болезни.
В 2006 году ученые из Российского центра функциональной хирургической гастроэнтерологии исследовали использование системного препарата интерферона-α2b в послеоперационной терапии. Ученые наблюдали динамику воспаления и количества Хеликобактер пилори при традиционном лечении и при иммунотерапии ИФН-α2b.
В исследовании участвовали 49 человек с хроническим гастритом и язвенной болезнью двенадцатиперстной кишки. Всем пациентам проводилась радикальная дуоденопластика, и последующее восстановительное лечение.
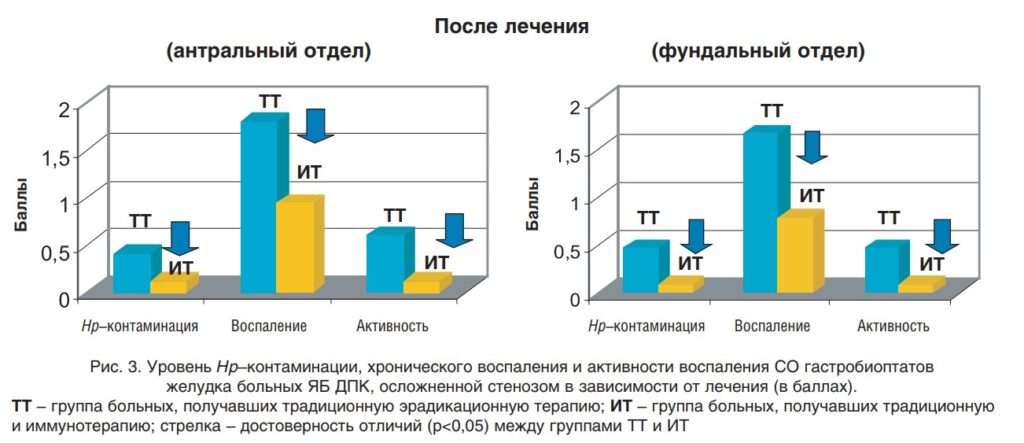
Исследование показало, что если в раннем послеоперационном периоде включить для иммунотерапии системный препарат ИФН-α2b, то численность бактерией Хеликобактер уменьшаешься примерно в 3 раза в антральном отделе желудка, а в фундальном отделе – в 5 раз. При этом уровень воспаления в обоих отделах снижается в 2 раза:
Источник изображения:
https://www.rmj.ru/articles/obshchie-stati/Effektivnosty_rekombinantnogo_interferona_a2b_pri_eradikacii_Helicobacter_pylori_u_pacientov_s_osloghnennoy_yazvennoy_boleznyyu_dvenadcatiperstno/
Вклад интерферона-гамма в защиту от инфекции Хеликобактер пилори
Одно из первых исследований, посвященное роли интерферонов при заражении Хеликобактером, провели в 1999 году ученые Медицинского университета Киото (Япония). Специалисты показали, что генно-модифицированные мыши, не способные вырабатывать интерферон-гамма, были на 30% более подвержены заражению Хеликобактер пилори, чем мыши дикого типа. Причем у генно-модифицированных мышей концентрация бактерии была выше.
Однако у мышей дикого типа через 15 месяцев после заражения развились эрозии в эпителии желудка, а у мышей, не способных вырабатывать ИФН-γ, не было симптомов воспаления. Причем у мышей дикого типа легкая степень воспаления желудка появилась уже через 4 недели, а средняя – через 8 недель.
В то же время штамм Хеликобактер пилори, который не был способен колонизировать мышей дикого типа, успешно заражал мышей, не способных вырабатывать интерферон-гамма.
Ученые сделали вывод, что ИФН-γ играет важную роль в защите от инфицирования Хеликобактер пилори. Но в то же время интерферон-гамма стимулирует воспаление желудка, когда инфицирование уже произошло.
Вывод
Бактерия Хеликобактер блокирует сигналы интерферона, чтобы защититься от реакции иммунной системы и создать для себя безопасные области. Защитный механизм основан на извлечении холестерина из мембран эпителиальных клеток желудка. В результате нарушается геометрия рецепторов ИФН, и клетки не вырабатывают белки антибактериальной защиты. Диета, богатая холестерином, значительно снижает уровень Хеликобактер, но усиливает воспаление и может вызвать тяжелый гастрит.
Полезная статья, нужная информация? Поделитесь ею!
Кому-то она тоже будет полезной и нужной:
Источники
- Immune evasion strategies used by Helicobacter pylori
- Helicobacter pylori Infection Elicits Type I Interferon Response in Human Monocytes via Toll-Like Receptor 8 Signaling
- Helicobacter pylori Depletes Cholesterol in Gastric Glands to Prevent Interferon Gamma Signaling and Escape the Inflammatory Response
- Cholesterol glucosylation promotes immune evasion by Helicobacter pylori
- The Relationship Between Updated Sydney System Score and LDL Cholesterol Levels in Patients Infected with Helicobacter pylori
- Эффективность рекомбинантного интерферона a2b при эрадикации Helicobacter pylori у пациентов с осложненной язвенной болезнью двенадцатиперстной кишки
- Role of Gamma Interferon in Helicobacter pylori-Induced Gastric Inflammatory Responses in a Mouse Model