Содержание
- Противовирусный ответ интерферона на SARS-CoV-2
- OncoTherad
- Цинк
- Витамин D
- Глютамин
- Омега-3
- Вывод
- Источник
Белок-шип (S) SARS-CoV-2 связывается с рецептором ACE2, который экспрессируют альвеолярные клетки легких, эпителиальные клетки носа и кишечника, а также эндотелиальные клетки сосудов. После связывания с ACE2 S-белки расщепляются клеточным ферментом TMPRSS2. Мембраны клетки и SARS-CoV-2 сливаются, геном SARS-CoV-2 высвобождается в клетку, и начинается размножение вируса.
Некоторые питательные вещества стимулируют врожденную и приобретенную иммунную систему и способствуют противовирусной устойчивости. Совместное действие нескольких питательных веществ может быть шире, чем действие отдельных препаратов, и потому эффективно предотвращать заражение или подавлять SARS-CoV-2.
Бразильские ученые исследовали, насколько усиливает иммунный ответ на коронавирус комбинация таких веществ и препаратов как:
- цинк;
- витамин D3;
- глутамин;
- OncoTherad – противоопухолевый препарат и иммуномодулятор, который используется для лечения мышечно-неинвазивного рака мочевого пузыря.
У цинка, витамина D3, глутамина и OncoTherad есть общий механизм действия: все эти препараты улучшают ответ интерферонов – противовирусных сигнальных молекул.
Дефицит питательных веществ может мешать лечению COVID-19, в то время как синергическое действие цинка, витамина D3, глутамина, а также OncoTherad может дать профилактический и лечебный эффект против COVID-19.
Противовирусный ответ интерферона на SARS-CoV-2
После того, как вирус инфицировал клетки, внутриклеточные рецепторы распознавания образов определяют присутствие чужеродных молекул. Рецепторы распознавания образов TLR обнаруживают вирусные нуклеиновые кислоты. Среди этих TLR: TLR2, TLR3, TLR4, TLR7, TLR8 и TLR9.
Взаимодействие чужеродных молекул с рецепторами распознавания образов запускает противовирусный иммунный ответ – клетки вырабатывают интерферон и другие воспалительные сигнальные молекулы (цитокины), которые обладают противовирусным действием и тормозят размножение инфицированных клеток.
Интерфероны (ИФН) – первая линия защиты от вирусных инфекций. В ответ на проникновение вируса инфицированные и иммунные клетки секретируют ИФН. ИФН связывается с рецепторами на клеточной поверхности и запускает экспрессию стимулированных интерфероном генов (ISG), которые подавляют размножение вируса как в инфицированной клетке, так и в соседних.
Быстрый и эффективный иммунный ответ необходим для ограничения распространения вируса. Однако чрезмерно высокие уровни провоспалительных цитокинов и хемокинов в сыворотке крови вызывают неконтролируемое системное воспаление, которое увеличивает тяжесть таких вирусных инфекций как грипп, SARS-CoV-2 и другие коронавирусы. Интерфероны могут подавлять воспаление. Они снижают выработку таких провоспалительных цитокинов как IL-1, IL-18 и IL-12, а также увеличивают производство противовоспалительного цитокина IL-10.
Неконтролируемое системное воспаление – основной механизм острого респираторного дистресс-синдрома (ОРДС), основной причины смерти от COVID-19. Интерфероны играют важную роль в лечении COVID-19 не только за счет своего противовирусного действия, но и за счет уравновешивания цитокинового шторма.
SARS-CoV-2 подавляет выработку интерферонов. Подавление ИФН связано с тяжелым COVID-19 и повышенной смертностью:
- Снижение экспрессии ИФН-γ в Т-хелперных клетках связано с тяжелым COVID-19.
- Китайское исследование на образцах ткани легких человека показало, что SARS-CoV-2 не приводит к экспрессии ИФН I, II или III.
Интерфероны применяются для лечения и профилактики COVID-19.
OncoTherad
OncoTherad помогает иммунной системе устранить рак и может повысить эффективность профилактики и лечения SARS-CoV-2. Доклинические, клинико-ветеринарные и клинические испытания фазы I / II показали, что OncoTherad стимулирует врожденный иммунитет, активируя систему интерферонов.
OncoTherad активирует рецепторы TLR2 и TLR4, что приводит к увеличению выработки ИФН. Это способствует активации T-киллеров, дендритных клеток и провоспалительных макрофагов. Так как SARS-CoV-2 подавляет систему интерферона, а OncoTherad способствует выработке ИНФ, этот препарат может быть полезен для борьбы с инфекцией SARS-CoV-2 и снижения тяжести повреждения легких.
Клинические исследования
- Клиническое применение OncoTherad при COVID-19 показало, что у 5 пациентов, у которых развилась тяжелая форма COVID-19 во время лечения мышечно-неинвазивного рака мочевого пузыря, введение OncoTherad с кортикостероидами и антибиотиками смягчило обострение воспалительной реакции в легких, сократило среднюю продолжительность пребывания в больнице с 18 до 10 дней и предотвратило необходимость интубации.
- Другое исследование описывает клинический случай 78-летнего бразильского мужчины с резистентным к лечению БЦЖ рецидивирующим мышечно-неинвазивным раком мочевого пузыря. У пациента был подтвержденный ПЦР-тестом COVID-19 и острый воспалительный процесс в легких. До заражения SARS-CoV-2 пациенту назначили OncoTherad для лечения рака: одно внутрипузырное и одно внутримышечное введение в неделю в течение 4 недель. Пациент на 2 недели прервал лечение, чтобы отправиться в путешествие. После появления симптомов COVID-19 и поступления в больницу пациент продолжил прием OncoTherad с однократным внутримышечным введением для лечения рака. Схема лечения COVID-19 включала оксигенотерапию (поток через носовой катетер 4 л / мин), цефтриаксон 2 г (в течение 6 дней, внутривенно), азитромицин 500 мг (в течение 6 дней, внутривенно) и Тамифлю 75 мг (2 раза в день в течение 5 дней, перорально). Через 72 часа после госпитализации симптомы насморка и кашля улучшились, лихорадка исчезла. Однако у пациента сохранялись потеря аппетита и утомляемость при минимальных нагрузках. Кислородная терапия была продолжена, и через 6 дней госпитализации у пациента наблюдалось значительное улучшение легочного воспаления (сатурация 94% при комнатной температуре). Кислородная терапия была отменена, значительное клиническое улучшение наблюдалось на 8-й день болезни (сатурация 98%, уменьшение признаков воспаления легких, отсутствие лихорадки, ослабление кашля и повышение аппетита). Пациент выписан на 10-е сутки госпитализации в хорошем общем состоянии.
Китайское исследование показало, что 86% пациентов с инфекцией SARS-CoV-2 были выписаны через 16 дней госпитализации, радиологическое ухудшение наблюдалось на 7-й день, улучшение – на 14-й день. Бразильский пациент, принимавший OncoTherad, выздоровел за более короткий период времени (10 дней), чем обычно при COVID-19.
Принимая во внимание сопутствующие заболевания и возраст пациентов, ученые считают, что OncoTherad оказал защитный эффект, предотвращая прогрессирование инфекции до тяжелого COVID-19 и способствуя быстрому выздоровлению без необходимости госпитализации в отделение интенсивной терапии.
Цинк
Предыдущие исследования показали, что цинк оказывает противовирусное действие против SARS-CoV, риновируса, гриппа, вируса герпеса, респираторно-синцитиального вируса, гепатита Е и вируса трансмиссивного гастроэнтерита. Голландские ученые показали, что цинк подавляет репликацию вируса в клетках, инфицированных SARS-CoV. При вирусной инфекции цинк усиливает передачу сигналов интерферона. В свою очередь интерфероны стимулируют приток цинка в зараженные клетки. Это подчеркивает важность цинка для передачи сигналов интерферона.
Цинк стимулирует выработку ИФН-α и ИФН-γ и усиливает противовирусное действие ИФН-α. Американские ученые показали, что цинк и клеточный переносчик цинка ZIP8 регулируют экспрессию ИФН-γ в активированных Т-лимфоцитах человека. Цинк в дозировке 15 мг / день перорально увеличивал продукцию ИФН-γ активированными Т-лимфоцитами.
Цинк – жизненно важный фактор защиты эпителия легких от острых повреждений. Американские ученые показали, что в отсутствие цинка ИФН-γ, TNF-α и активация рецептора смерти Fas на поверхности клеток могут привести к гибели эпителиальных клеток легких и дисфункции легочного эпителиального барьера.
Немецкое исследование показало, что дефицит цинка связан с повышенной восприимчивостью к инфекциям. Причина – в ухудшении передачи сигналов интерферона. Напротив, повышенные концентрации цинка могут ограничивать репликацию вируса гепатита E за счет повышения эффективности передачи сигналов ИФН и выработки противовирусных ISG в ответ на сигнал интерферона.
Интерферон запускает в клетке синтез мембранных белков IFITM. Эти белки обладают противовирусными свойствами. Ученые Гарвардской медицинской школы в США показали, что белки IFITM играют решающую роль в подавлении таких оболочечных вирусов как вирус гриппа A и вирус Эбола. Такую же противовирусную активность проявляет и металлопротеиназа цинка (белок ZMPSTE24). Цинк стимулирует интерфероновый ответ на инфекцию оболочечным вирусом, а интерферон запускает синтез противовирусных белков IFITM3 и ZMPSTE24. Так как SARS-CoV-2 – оболочечный вирус, ученые предполагают, что повышение уровня белков IFITM и / или ZMPSTE24, вызванное цинком, может быть эффективным в борьбе с COVID-19.
Цинк важен для передачи сигналов рецепторов иммунных клеток. Один из рецепторов – TLR4, который распознает вирусные нуклеиновые кислоты и участвует в иммунном ответе на инфекцию. После активации TLR4 вызывает увеличение свободных ионов цинка, которые необходимы для экспрессии воспалительных цитокинов, способствующих противовирусной защите.
Дефицит цинка – причина нарушения вкуса и секреции слюны при COVID-19
Коронавирус может вызвать нарушение вкуса и слюноотделения. Иногда эти симптомы сохраняются в течение одного года после выздоровления от COVID-19.
Японские ученые обнаружили, что нарушение вкуса и слюноотделения связано с дефицитом цинка.
Цинк необходим для восприятия вкуса и секреции слюны. Он присутствует в высоких концентрациях во вкусовых рецепторах и клетках слюнных желез. Дефицит цинка приводит к снижению вкусовой чувствительности и нарушению слюноотделения.
Дефицит цинка – часть иммунного ответа на коронавирус. Коронавирус приводит к дефициту цинка. Уровень цинка в сыворотке крови пациентов с COVID-19 значительно ниже, чем у пациентов без COVID-19 и здоровых людей. Снижение концентрации цинка в сыворотке – один из механизмов иммунного ответа. Этот механизм подавляет вирусную репликацию, ухудшая доступность цинка для вируса, и активирует иммунные клетки для уничтожения инфекции.
Коронавирус вызывает нарушения вкуса, заражая клетки вкусовых рецепторов и слюнных желез. Проникая во вкусовые рецепторы и клетки слюнных протоков и желез, SARS-CoV-2 повреждает их и поэтому может вызвать нарушения вкуса и секреции слюны. Вирусная инфекция и воспаление слюнных желез приводят к изменению состава слюны. А изменение вкуса связано с изменением скорости слюноотделения и концентрации компонентов слюны, включая цинк и цинк-связывающий белок.
Добавки цинка могут ускорить восстановление вкуса после COVID-19. Поскольку дефицит цинка связан с нарушениями вкуса и слюноотделения, добавки цинка могут уменьшить оральные симптомы у пациентов с COVID-19. Однако передозировка цинка может привести к окислительному стрессу и повреждению тканей. Поэтому принимать добавки цинка можно только по назначению врача.
Детали исследования – в статье «Изменился вкус после коронавируса – виноват дефицит цинка». Исследование опубликовано в журнале Life издательства MDPI.
Цинк усиливает синтез интерферона у пожилых, но передозировка цинка нарушает работу иммунной системы
С возрастом иммунные клетки хуже вырабатывают ИФН-α в ответ на вирусную инфекцию. Это подтвердило исследование немецких ученых с участием 468 человек в возрасте от 1 до 90 лет. Кроме того, пожилые люди хуже усваивают цинк, чем молодые. При этом дефицит цинка нарушает иммунные реакции и ухудшает заживление ран.
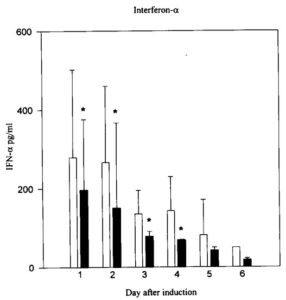
Ученые Любекского университета (Германия) исследовали, как добавки цинка влияют на выработку интерферона-альфа иммунными клетками у людей разных возрастов. Средний возраст пожилых участников – 73 года, молодых – 28 лет.
Общее количество иммунных клеток у пожилых и молодых отличалось незначительно. Однако синтез ИФН-α у молодых участников (белые столбцы) был ощутимо выше, чем у пожилых (черные столбцы):
Источник изображения: https://www.liebertpub.com/doi/10.1089/jir.1997.17.469
Раствор цинка в концентрации 15 мкМ повышал выработку ИФН-α у обеих групп участников. У пожилых синтез интерферона-альфа увеличивался до уровня молодых. Оптимальная концентрация цинка для стимуляции выработки ИФН-α была 15-25 мкМ.
Чрезмерное потребление цинка нарушает работу иммунной системы. Концентрации выше 50 мкМ подавляли синтез интерферона-альфа: уровень интерферона был ниже, чем без добавления раствора цинка.
Детали исследования – в статье «Добавки цинка усиливают синтез интерферона у пожилых». Исследование опубликовано в журнале Journal of Interferon & Cytokine Research.
Клинические исследования
- Итальянское исследование с участием 21 здорового пожилого человека (средний возраст 87 лет) показало, что употребление обогащенного цинком молока (3 мг добавленного цинка плюс 1 мг цинка, естественно присутствующего в молоке) в течение 2 месяцев, по сравнению с употреблением необогащенного молока, повысило клеточный иммунитет. Об этом свидетельствуют повышение уровней ИФН-γ и IL-12p70 в образцах периферической крови в ответ на стимуляцию эндотоксином, а также повышение эндокринной активности в тимусе.
- Другое исследование с участием 19 здоровых пожилых людей, получавших 10 мг элементарного цинка (50 мг аспартата цинка), также показало, что добавка цинка привела к значительному увеличению высвобождения провоспалительных цитокинов ИФН-γ и TNF-α. Это подтверждает, что добавление цинка улучшает иммунный ответ Т-лимфоцитов.
Витамин D
Витамин D3 – гормон, который вырабатывается в организме и участвует в регуляции >200 генов в различных типах клеток. Витамин D3 превращается в свою активную форму (кальцитриол) под действием фермента 1α-гидроксилазы (CYP27B1). Иммунные клетки экспрессируют CYP27B1 и рецепторы витамина D3, экспрессия этих рецепторов регулируется иммунной сигнализацией. Вывод: витамин D играет важную роль в иммунной системе. Низкий уровень 25 (OH) D3 в сыворотке крови связан с аутоиммунными и сердечно-сосудистыми заболеваниями, раком и респираторными инфекциями. Витамин D3 необходим клеткам респираторного эпителия. Это подтверждает то, что клетки респираторного эпителия постоянно экспрессируют CYP27B1.
Витамин D необходим для противовирусного иммунитета. При встрече с вирусными нуклеиновыми кислотами активируются рецепторы распознавания образов. Это приводит к повышенной экспрессии рецептора витамина D и CYP27B1. От этого преобразование циркулирующего витамина D в его активную форму становится интенсивнее. Вывод: метаболизм витамина D связан с распознаванием патогенов и является неотъемлемой частью врожденного иммунного ответа.
Это подтверждают лабораторные исследования:
- Активация TLR4 с помощью эндотоксина приводит к повышенной экспрессии CYP27B1 в моноцитах.
- Активация TLR4 или TLR3 запускает экспрессию CYP27B1 в дендритных клетках, изменяя миграционные свойства этих клеток, чтобы обеспечить представление антигенов Т-лимфоцитам.
- В трахеобронхиальных эпителиальных клетках человека стимуляция TLR увеличивает экспрессию CYP27B1. Это приводит к усиленному превращению витамина D3 в его активную форму и повышенной экспрессии антимикробных пептидов, обладающих противовирусным действием.
Если уровень циркулирующего витамина D достаточный, то активация TLR при заражении респираторным вирусом, ведущая к секреции цитокинов, повышает уровень кальцитриола, оптимизируя иммунный ответ для борьбы с вирусом.
Это подтверждают исследования:
- Цитокины ИФН-γ, IL-13, IL-15, IL-4, IL-1, IL-2 и TNF-α регулируют экспрессию CYP27B1 и метаболизм витамина D. Сигнальные пути, которые участвуют в этом процессе, такие же, как и при активации TLR.
- Витамин D необходим для зависящего от ИФН-γ антимикробного иммунного ответа макрофагов человека против Mycobacterium tuberculosis.
Для входа в клетку SARS-CoV-2 связывается с ACE2. Однако предположение, что высокая экспрессия ACE2 приносит вред, – неверно. ACE2 противостоит острому респираторному дистресс-синдрому и повреждению легких при COVID-19. Связывание SARS-CoV-2 с ACE2 снижает активность ACE2, что увеличивает активность ACE1. Из-за этого кровеносные сосуды легких сужаются, что усугубляет тяжесть COVID-19. Витамин D увеличивает экспрессию ACE2 в легких. Это предотвращает сужение легочных сосудов при COVID-19 и уменьшает повреждение легких.
Клинические исследования
- Добавление витамина D3 (1000 или 2000 МЕ / день) повышает эффективность противовирусного лечения пегилированным интерфероном и рибавирином (ПЭГ-ИФН / RBV) у пациентов с гепатитом C.
- Низкие концентрации витамина D3 в сыворотке связаны с тяжелым фиброзом печени и / или с меньшей чувствительностью к лечению ПЭГ-ИФН / рибавирином.
Глютамин
Глютамин – это источник азота для быстро делящихся клеток. Среди таких клеток – лимфоциты, которым глютамин необходим для синтеза нуклеотидов и производства энергии. Т-лимфоциты быстро активируются после взаимодействия с патогенами. Это требует больших затрат энергии и интенсивного биосинтеза.
Глютамин влияет на иммунный ответ:
- Он необходим для деления Т-лимфоцитов. Недостаток глютамина нарушает функцию Т-лимфоцитов.
- Активированным Т-лимфоцитам глютамин необходим для продукции ИФН-γ и IL-2.
- Недостаток глютамина ухудшает противовирусную защиту. При встрече с вирусом наивный Т-лимфоцит меняет свои функции. Он может стать эффекторным Т-лимфоцитом, который усиливает иммунный ответ (Т-хелпер, Th1), а может – регуляторным Т-лимфоцитом, который подавляет иммунные реакции. Какие функции приобретет Т-лимфоцит – зависит от цитокинов и доступности глютамина.
- Даже в присутствии цитокинов, которые обычно способствуют образованию клеток Th1, недостаток глютамина приводит к образованию регуляторных Т-лимфоцитов, подавляющих противовирусный ответ.
Прием глютамина подавляет репликацию вируса герпеса. Исследования показали, что у мышей, получавших глютамин, были обнаружены более низкие уровни вируса, более высокое количество активных T-хелперов и T-киллеров в селезенке и повышенные уровни ИФН-γ во влагалищной жидкости. Это – признаки клинического улучшения. Напротив, дефицит глютамина увеличивал репликацию вируса герпеса.
В другом исследовании американские ученые с помощью биоинформационных технологий вычислили, что глутатион и его предшественник глютамин могут предотвратить проникновение SARS-CoV-2 в клетки и подавить измененную экспрессию генов, связанную с коронавирусом.
Клинические исследования
- Низкие уровни глютамина в плазме связаны с плохим клиническим исходом у пациентов отделения интенсивной терапии. После травмы и хирургического вмешательства концентрация глютамина в плазме и мышцах снижена, а T-лимфоциты приобретают иммуносупрессивные свойства. Эти изменения увеличивают риск инфекционных осложнений: пневмонии, сепсиса и бактериемии. Обогащенное глютамином питание увеличивает плазменные концентрации глютамина и снижает частоту инфекционных осложнений у пациентов с тяжелой травмой.
- Глютамин восстанавливает способность Т-лимфоцитов к иммунному ответу. У пациентов с тяжелой травмой активированные T-лимфоциты демонстрировали низкую продукцию ИФН-γ – травма подавляла иммунный ответ. Прием глютамина увеличил выработку ИФН-γ и способствовал нормальной продукции IL-4.
- Кокрановский систематический обзор и метаанализ 57 клинических испытаний с участием пациентов с серьезными заболеваниями или перенесших серьезную операцию показал, что прием глютамина снижает риск инфекционных осложнений на 21%. Кроме того, прием глютамина снижает среднюю продолжительность госпитализации и искусственной вентиляции легких на 3,46 и 0,69 суток соответственно.
Омега-3
Ученые Седарс-Синайского медицинского центра (США) и Научно-исследовательского института жирных кислот (США) исследовали, как влияет уровень омега-3 на заболеваемость и смертность от COVID-19.
Одна из причин тяжелого и смертельного COVID-19 – повышение уровня воспалительных цитокинов TNF-альфа, IL-1β и IL-6, которое приводит к синдрому высвобождения цитокинов или цитокиновому шторму.
Ученые оценивали индекс омега-3 (O3I) у 100 пациентов с COVID-19. O3I – уровень полиненасыщенных жирных кислот EPA и DHA в эритроцитах. Ученые обнаружили, что у пациентов с O3I ≥ 5,7% риск смерти от COVID-19 на 75% меньше, чем у пациентов с более низким O3I.
Омега-3 (DHA и EPA), которые содержатся в рыбьем жире, уменьшают воспалительные реакции и снижают выброс воспалительных цитокинов:
- Чем выше индекс омега-3, тем ниже уровень таких воспалительных биомаркеров как С-реактивный белок, IL-6, молекула межклеточной адгезии-1 ICAM-1, ацетилгидролазафактора активации тромбоцитов LpPLA2, рецептор TNF 2 и остеопротегерин.
- Прием EPA 3 г/день в течение 10 недель значительно снижал экспрессию TNF-α. Аналогичная доза DHA, кроме того, снижала уровень IL-6 и MCP-1.
- Добавки с EPA и DHA снижают высокий уровень циркулирующих провоспалительных цитокинов у пожилых людей.
Клинические исследования
Международный коллектив ученых провел мета-анализ результатов лечения у 1280 пациентов с COVID-19, находящихся в отделении интенсивной терапии с острым респираторным дистресс-синдромом. У пациентов, получавших омега-3, значительно улучшались показатели оксигенации крови и сокращалась продолжительность пребывания в отделении интенсивной терапии и ИВЛ.
Обзор исследований о противовоспалительном эффекте омега-3 при COVID-19 – в статье «Омега-3 жирные кислоты защищают от COVID-19».
Вывод
Препарат OncoTherad, который применяется для лечения мышечно-неинвазивного рака мочевого пузыря, ускоряет выздоровление при COVID-19. Причина этого – в усилении сигналов интерферона. Цинк, витамин D3 и глютамин также улучшают противовирусный ответ интерферона. Комбинация этих препаратов может эффективно подавлять SARS-CoV-2.
Полиненасыщенные жирные кислоты омега-3 обладают противовоспалительным эффектом, а также снижают риск осложнений и смерти при COVID-19. Уровень жирных кислот омега-3 можно повысить, увеличив потребление жирной рыбы, которая богата EPA и DHA, либо принимая добавки омега-3.
Полезная статья, нужная информация? Поделитесь ею!
Кому-то она тоже будет полезной и нужной:
Источники
- Vitamin D, zinc and glutamine: Synergistic action with OncoTherad immunomodulator in interferon signaling and COVID‑19 (Review)
- Blood omega-3 fatty acids and death from COVID-19: A pilot study
- Global survey of the omega-3 fatty acids, docosahexaenoic acid and eicosapentaenoic acid in the blood stream of healthy adults
- Prevalence of Оmega-3 fatty acid deficiency in different age groups
- Zinc Supplementation Reconstitutes the Production of Interferon-α by Leukocytes from Elderly Persons