Содержание
- Иммунный ответ на SARS-CoV-2
- Как работает противовирусный иммунитет
- T-клетки снижают тяжесть COVID-19
- Не только антитела защищают от COVID-19
- T-клетки обеспечивают иммунитет, если нет антител к коронавирусу
- Неоднородность иммунной памяти к SARS-CoV-2 и риск повторного заражения
- Сколько держится иммунитет к коронавирусу после естественного течения заболевания?
- Сохраняется ли иммунитет к SARS-CoV-2 после COVID-19 в легкой форме?
- Иммунитет к SARS-CoV-2 при бессимптомной коронавирусной инфекции
- Первоисточники
Иммунный ответ на SARS-CoV-2
В ответ на коронавирус SARS-CoV-2 организм вырабатывает специфические антитела, B-клетки и T-клетки CD4+ и CD8+. При выздоровлении примерно 90% этих вирус-специфических клеток умирают, а 10% сохраняются в виде долгоживущих клеток памяти.
CD4+ Т-клетки памяти (T-хелперы) помогают активировать патоген-специфические B-клетки памяти и секретируют сигнальные молекулы цитокины, включая IFNγ, для активации клеток врожденного иммунитета. CD8+ Т-клетки памяти (T-киллеры) могут убивать инфицированные вирусом клетки напрямую с помощью доставки молекул, разрушающих клетки. Клетки иммунной памяти помогают организму быстро избавиться от вируса, предотвращая болезнь и снижая вероятность передачи вируса.
Чтобы инфицировать клетки и размножаться, SARS-CoV-2 использует структуру на конце своего белка-шипа (S). Эта структура – рецептор-связывающий домен (RBD) – связывается с рецептором ACE2 клетки человека, и вирус проникает в клетку.
Большинство людей, инфицированных SARS-CoV-2, производят S- и RBD-специфические антитела при первичном иммунном ответе. RBD-специфические моноклональные антитела (полученные из копий одного B-лимфоцита) могут нейтрализовать вирус in vitro и in vivo.
Завершающая стадия развития В-лимфоцитов – плазматические клетки. Это основные клетки, вырабатывающие антитела в организме человека. Если специфические антитела к RBD экспрессируются долгоживущими плазматическими клетками (LLPC) или патоген-специфическими B-клетками памяти (MBC), вероятно, эти антитела смогут защитить от повторного заражения коронавирусом SARS-CoV-2.
Как работает противовирусный иммунитет
Организм умеет уничтожать патогены, с которыми сталкивался ранее. Эта способность называется приобретенным иммунитетом. Приобретенный иммунитет может убивать инфицированные вирусом клетки и генерировать защитную иммунологическую память. Именно она является основой стратегий вакцинации.
Для борьбы с вирусами и развития иммунологической памяти важны ответы Т-клеток и В-клеток. Попадая в клетку организма, вирусы берут на себя управление клеточными механизмами, чтобы создавать новые вирусные частицы и распространяться на здоровые клетки. Вирусные инфекции вызывают врожденные иммунные реакции, например, воспаление. Эти реакции активируют приобретенный иммунитет. Дендритные клетки захватывают вирусные белки и частицы и транспортируют их в лимфоидные органы – селезенку и лимфатические узлы. Там вирусные белки и частицы распознаются Т- и В-клетками. Клеточная (Т-клеточная) и гуморальная (В-клеточная) ветви приобретенного иммунитета работают вместе, обеспечивая вирус-специфическую защиту.
Механизм распознавания и устранения вируса
Как Т-клеточное распознавание вирусных пептидов, так и В-клеточное распознавание вирусных белков начинаются в лимфоидных тканях, где дендритные клетки представляют пептиды Т-клеткам, а В-клетки отбирают вирусные белки. Вместе они инициируют развитие эффекторных клеток для устранения вируса.
Величина ответов Т- и В-клеток определяется:
- патогенностью вируса;
- степенью воспаления;
- частотой вирус-специфических Т- и В-клеток;
- кинетикой репликации вируса.
CD8+ Т-клетки – T-киллеры – дифференцируются в эффекторные клетки, которые ограничивают репликацию вируса, уничтожая инфицированные клетки. CD4+ Т-клетки – T-хелперы – дифференцируются в эффекторные клетки, которые подавляют репликацию вируса и поддерживают CD8+ Т-клетки, а также дифференцировку В-клеток. Как CD8+, так и CD4+ Т-клетки продуцируют противовирусный и иммуномодулирующий пептид интерферон гамма. Чтобы запустить противовирусную реакцию, эффекторные Т-клетки могут проникать в кровоток и перемещаться к очагам инфекции.
CD4+ Т-клетки также дифференцируются в фолликулярные Т-хелперы (ТFH), которые необходимы для развития продуцирующих антитела В-клеток и поддерживают развитие В-клеток памяти. ТFH имеют решающее значение для формирования зародышевых центров в фолликулах периферических лимфоидных органов.
Антитела могут нейтрализовать вирусы, предотвращая проникновение в клетки или способствуя гибели инфицированных клеток. В результате скоординированного взаимодействия врожденного и приобретенного иммунитета пиковые реакции Т- и В-клеток приводят к снижению вирусной нагрузки и ослаблению воспаления, часто в течение одной недели после заражения.
T- и B-клетки памяти
После удаления вируса большинство эффекторных Т- и В-клеток погибают. Сохранившиеся Т-клетки становятся Т-клетками памяти. Сохранившиеся В-клетки генерируют либо долгоживущие плазматические клетки, продуцирующие антитела, либо становятся В-клетками памяти. Клетки памяти способны быстро реагировать на повторное заражение.
SARS-CoV-2-специфические CD4+ и CD8+ Т-клетки обнаруживаются в кровотоке как у активно инфицированных, так и у выздоровевших пациентов, что свидетельствует о потенциальной способности развития защитного клеточного иммунитета.
Т-клетки памяти бывают:
- эффекторными – реагирующими при высоких титрах вируса;
- центральными – служащими резервуаром для защиты во время будущих реинфекций.
Т-клетки, расположенные в очагах инфекции, могут стать тканево-резидентными T-клетками памяти (TRM).
Что определяет эффективность приобретенного иммунного ответа
Когда приобретенные иммунные ответы на инфекцию неоптимальны или вирус развил средства для уклонения от иммунных ответов (включая подавление вирусом иммунитета), может наступить хроническая инфекция или системное заболевание и смерть, особенно у лиц из группы риска. Тяжесть заболевания при коронавирусе SARS-CoV-2 различна. Поэтому необходимо понимать, какие факторы определяют эффективность приобретенного иммунного ответа и длительный защитный иммунитет, особенно в уязвимых группах населения: пожилых и людей с ослабленным иммунитетом.
Ключевой фактор в устранении вирусных инфекций – устойчивые высокоэффективные противовирусные реакции Т- и В-клеток. Наивные Т- и В-клетки имеют на поверхности разнообразные рецепторы вирусного распознавания, поэтому могут распознавать широкий диапазон вирусов. Во время инфекции отбираются T-клетки с наиболее подходящими T-клеточными рецепторами – они обладают большей способностью связывать вирусные пептиды. Сродство B-клеточных рецепторов к вирусным белкам продолжает увеличиваться в ходе инфекции через процессы соматической гипермутации и клональной экспансии. Соматическая гипермутация – механизм, обеспечивающий разнообразие B-клеточных рецепторов и антител. Благодаря ему иммунная система может распознавать больше различных патогенов. Клональная экспансия – процесс деления B-клеток, при котором из одной клетки появляется множество копий.
B-клетки переключаются с раннего синтеза антител класса M (IgM) на синтез антител IgG и IgA с более высоким сродством. Эти антитела обнаруживаются в сыворотке выздоравливающих пациентов с COVID-19.
Величина ранних ответов антител может свидетельствовать о тяжести инфекции, поскольку более высокие титры антител IgM и IgG ассоциированы с более тяжелым заболеванием. Как и в случае с другими вирусными инфекциями, общие титры антител к SARS-CoV-2 в сыворотке крови уменьшаются после излечения активной инфекции. Однако долгоживущие В-клетки памяти могут сохраняться и продуцировать циркулирующие вируснейтрализующие антитела. Недавнее исследование показало, что через 6-8 месяцев после начала заболевания COVID-19 нейтрализующие антитела против SARS-CoV-2 были обнаружены у 90% выздоровевших пациентов. Также важно отслеживать и сравнивать продолжительность реакции В-клеток памяти на естественную инфекцию SARS-CoV-2 и вакцины.
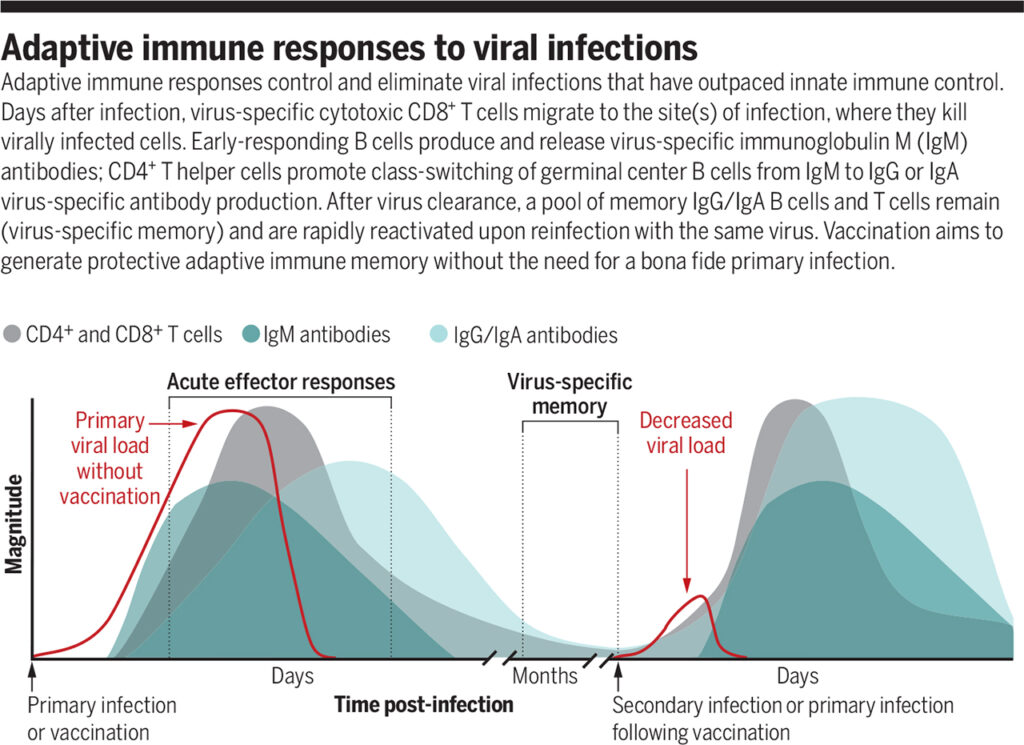
Приобретенный иммунный ответ на вирусные инфекции
Источник: https://www.science.org/doi/full/10.1126/science.abf6446
Приобретенный иммунный ответ контролирует и устраняет вирусные инфекции, опередившие врожденный иммунный контроль. Через несколько дней после заражения вирус-специфические цитотоксические CD8+ Т-клетки мигрируют к месту инфекции, где убивают инфицированные вирусом клетки. В-клетки с ранним ответом продуцируют вирус-специфические антитела IgM. CD4+ Т-хелперные клетки способствуют переключению класса В-клеток зародышевого центра с IgM на IgG или выработке вирус-специфических антител IgA. После удаления вируса сохраняются B-клетки памяти IgG / IgA и Т-клетки памяти. Они быстро реактивируется при повторном заражении тем же вирусом. Вакцинация направлена на формирование защитной приобретенной иммунной памяти без необходимости в подлинной первичной инфекции.
Перекрестно-реактивные T- клетки и антитела
На ответы приобретенного иммунитета могут влиять предыдущие встречи с вирусами. Например, ТRM-клетки, находящиеся в легких, могут распознавать внутренние структурные белки вирусов гриппа и впоследствии снижать тяжесть заражения новыми штаммами вируса гриппа. Т-клетки, реактивные к белкам SARS-CoV-2, были обнаружены у лиц, ранее инфицированных SARS-CoV, и у здоровых людей, не подвергавшихся воздействию этих коронавирусов. Эти результаты показывают, что Т-клетки памяти генерируются при заражении другими коронавирусами человека (HCoV), включая простудные коронавирусы. Было обнаружено, что антитела IgG пациентов с COVID-19 сильно реагируют на белки вируса гепатита C. Напротив, SARS-CoV-2-реактивные антитела, специфические для белков HCoV, были обнаружены в сыворотках людей, не болевших COVID-19, – это могут быть широко нейтрализующие антитела.
Пока неясно, могут ли уже существующие SARS-CoV-2-реактивные Т- и В-клетки способствовать улучшению исходов заболевания. Если они улучшают исход заболевания, то может быть желательно увеличить такие популяции Т- и В-клеток с помощью вакцинации.
Чем опасна чрезмерная активация T-клеток
Важно отслеживать степень инфицирования и воспаления, вызванного вирусами, включая SARS-CoV-2. Чрезмерные врожденные иммунные ответы, такие как гипервоспаление (повышенный уровень интерлейкина-6 (IL-6) и С-реактивного белка), могут способствовать выраженной активации Т-лимфоцитов, которая еще больше усиливает воспаление и тяжесть заболевания. Обширная активация Т-клеток во время COVID-19 может привести к лимфопении (уменьшению количества лимфоцитов), изменению дифференцировки и потере функции Т-клеток. Это может замедлить вирусный клиренс, продлить инфекцию и повысить заболеваемость.
Факторы, прогнозирующие тяжесть заболевания
Остается неясным, почему у некоторых инфицированных людей симптомы отсутствуют, тогда как у других наблюдается тяжелый COVID-19. Однако с тяжелым COVID-19 связаны:
- Нарушение врожденных иммунных ответов интерферона I типа.
- Цитомегаловирус (CMV) и вирус простого герпеса 1 (HSV-1).
- Мужской пол. Мужчины, госпитализированные с COVID-19, имеют более сильный ответ антител и повышенную тяжесть заболевания по сравнению с женщинами.
- Возраст > 65 лет. У пожилых людей во время острой инфекции SARS-CoV-2 чаще наблюдались нерегулируемые реакции приобретенного иммунитета, чем у более молодых людей.
- Ранний профиль антител. Американские ученые обнаружили, что ранние различия в профилях антител к спайковому белку (S) и белку нуклеокапсида (N) коронавируса SARS-CoV-2 прогнозируют легкое или тяжелое течение COVID-19. S-антитела были повышены у выздоравливающих людей, тогда как N-антитела были повышены у умерших пациентов. Напротив, устойчивые Т-клеточные ответы на S, N и мембранный белок (M) не были связаны с лучшим выздоровлением у критически больных пациентов с COVID-19.
- Состав кишечного микробиома. Американские исследователи показали, что увеличение количества кишечных бактерий Enterococcus faecalis – главный предиктор тяжелого COVID-19.
Возможность выявления прогностических факторов будет увеличена за счет включения бессимптомных лиц, инфицированных SARS-CoV-2.
Опасные реакции приобретенного иммунитета на коронавирус SARS-CoV-2
Немецкие ученые обнаружили, что у активно инфицированных пациентов сильно мутировавшие рецепторы B-клеток и снижение клональной экспансии были связаны с более тяжелыми клиническими исходами, тогда как больший пул вирус-специфичных наивных В-клеток у пациентов коррелировал с развитием более эффективного противовирусного иммунного ответа.
Усиленная дифференцировка TH1, потеря TFH и связанное с этим отсутствие формирования зародышевого центра были недавно обнаружены при посмертном анализе лимфатических узлов и селезенки у пациентов, которые скончались в течение 10 дней с момента появления респираторных симптомов COVID-19. Измененные пропорции субпопуляций CD4+ Т-клеток периферической крови, статуса активации Т-лимфоцитов CD8+ и В-клеток также наблюдались у пациентов с тяжелым COVID-19. Углубленный анализ около 200 иммунных параметров показал, что тяжесть заболевания, включая тяжелое воспаление и органную недостаточность, коррелирует с общей лимфопенией, при этом оставшиеся лимфоциты: CD4+ и CD8+ эффекторные Т-клетки, клетки TFH и короткоживущие плазматические клетки, продуцирующие антитела – высокоактивированы и потенциально гиперактивированы.
T-клетки снижают тяжесть COVID-19
Нейтрализующие антитела, как правило, не связаны со снижением тяжести COVID-19. У нечеловекообразных приматов выработка нейтрализующих антител защищает от повторного заражения SARS-CoV-2 или SARS-CoV.
Введение нейтрализующих антител перед инфекцией имитирует повторное заражение. Оно эффективно ограничивает инфекцию верхних и нижних дыхательных путей, включая легкие, а также уменьшает симптомы коронавируса на животных моделях.
Введение нейтрализующих антител, проведенное после инфицирования у человека, оказывает более ограниченное воздействие на COVID-19. Это подтверждает значительную роль Т-клеток в контроле и очищении организма от SARS-CoV-2.
Исследования острых и выздоравливающих пациентов с COVID-19 показали, что Т-клеточные реакции связаны с уменьшением заболевания. Специфические для SARS-CoV-2 CD4+ и CD8+ Т-клетки могут играть важную роль для контроля и разрешения первичной инфекции SARS-CoV-2.
Для лучшего понимания стойкости защитного иммунитета против COVID-19, генерируемого первичной инфекцией SARS-CoV-2, важно дальнейшее комплексное изучение антител, B-клеток памяти, CD4+ и CD8+ Т-клеток памяти.
Не только антитела защищают от COVID-19
Хотя иммунологическая память является источником долгосрочного защитного иммунитета, прямые выводы о защитном иммунитете нельзя сделать на основе количественной оценки циркулирующих антител к SARS-CoV-2, B-клеток памяти, CD8+ и CD4+ T-клеток, поскольку механизмы защитного иммунитета против SARS-CoV-2 или COVID-19 у человека не определены. Тем не менее, можно сделать некоторые разумные интерпретации.
Антитела – единственный компонент иммунной памяти, который может обеспечить действительно стерилизующий иммунитет.
Исследования иммунизации на нечеловекообразных приматах показали, что циркулирующие титры нейтрализующих антител ~ 200 могут обеспечить стерилизующий иммунитет верхних дыхательных путей против относительно высокой дозы вируса SARS-CoV-2, а нейтрализующие титры ~ 3400 могут обеспечить стерилизующий иммунитет против очень высокой дозы вируса.
В то время как стерилизующий иммунитет против вирусов обеспечивают только нейтрализующие антитела с высоким титром, успешная защита от клинического заболевания или смерти может быть достигнута с помощью нескольких других сценариев адаптивной иммунной памяти.
CD4+ и CD8+ T-клетки памяти, а также B-клетки памяти, продуцирующие нейтрализующие RBD-антитела, могут ограничивать SARS-CoV-2 в верхних дыхательных путях и ротовой полости и минимизировать тяжесть COVID-19 до обычной простуды или бессимптомного заболевания.
У человека SARS-CoV-2-специфические CD4+ Т-клетки и CD8+ T-клетки связаны с уменьшением тяжести COVID-19 при продолжающейся инфекции SARS-CoV-2, а быстрое образование антител связано со значительным снижением вирусной нагрузки при остром заболевании в течение 14 дней. Эти факты согласуются с гипотезой о том, что Т-клетки и В-клетки памяти могут существенно ограничивать распространение SARS-CoV-2 и / или вирусную нагрузку, что приводит к значительному снижению тяжести заболевания COVID-19. Вероятность таких исходов тесно связана с кинетикой инфекции, поскольку ответы B- и Т-клеток памяти могут занять 3-5 дней, чтобы успешно отреагировать на инфекцию.
Учитывая относительно медленное течение тяжелого COVID-19 у людей, существует большое окно времени для того, чтобы иммунная память могла внести значимый вклад в защитный иммунитет против пневмонии, тяжелого или смертельного повторного COVID-19. Наличие нейтрализующих антител во время воздействия SARS-CoV-2 притупило бы размер первоначальной инфекции и могло бы внести дополнительный вклад в ограничение тяжести COVID-19.
T-клетки обеспечивают иммунитет, если нет антител к коронавирусу
Один из вариантов лечения тяжелых больных с коронавирусной болезнью COVID-19 – введение плазмы выздоравливающих. При поиске потенциальных доноров плазмы с подтвержденной ПЦР инфекцией SARS-CoV-2 немецкие ученые обнаружили, что у 17% добровольцев – пограничные или отрицательные результаты анализа на антитела IgG к SARS-CoV-2 (соотношение антител <1,1). Ученые решили понаблюдать за этими добровольцами, повторив тесты на антитела и оценив Т-клеточный иммунитет с помощью анализа ELISpot на интерферон гамма. Иммуноферментный анализ ELISpot поможет понять, сколько людей все еще могут заразиться коронавирусом SARS-CoV-2. ELISpot выявляет пациентов с адаптивным Т-клеточным иммунитетом, который, как и антитела IgG, может защищать от заражения коронавирусом. ELISpot измеряет клеточный иммунитет в течение 1 дня на уровне отдельных клеток, определяет функциональные клетки. Результаты исследования на добровольцах с подтвержденной инфекцией SARS-CoV-2 позволяют предположить, что большинство людей с неопределяемым системным уровнем IgG могут быть защищены специфическим Т-клеточным иммунитетом.
Суть анализа IFN-γ ELISpot
T-лимфоциты – клетки, отвечающие за иммунный ответ на вторжение патогена. Они распознают и уничтожают зараженные клетки и стимулируют выработку антител. При стимуляции антигеном T-лимфоциты продуцируют интерферон гамма (IFN-γ). Иммуноферментный анализ ELISpot определяет наличие в сыворотке крови интерферона-γ.
Для стимуляции T-лимфоцитов использовались антигены – белки коронавируса SARS-CoV-2: S1 / S2 и мембранный белок M. С помощью белка-шипа S коронавирус проникает в клетку. Белок S – главная мишень нейтрализующих антител. Фрагмент S1 белка S отвечает за связывание вируса с клеткой, а фрагмент S2 – за слияние вирусной мембраны с клеточной мембраной. S1 – наиболее специфичный антиген для диагностики COVID-19. Фрагмент S2 может перекрестно реагировать с белком S коронавирусов SARS-CoV-1 и MERS-CoV. Однако уровень инфицирования SARS-CoV-1 и MERS-CoV у европейцев низок. Второй стимул T-лимфоцитов – мембранный белок М. Он играет центральную роль в сборке вирусных частиц и, скорее всего, является мишенью для перекрестно-реактивных Т-клеток.
Ответы антител и Т-лимфоцитов в группе выздоравливающих от COVID-19
С помощью ELISpot, специфичного для SARS-CoV-2, ученые проанализировали ответы Т-лимфоцитов в группе 78 потенциальных доноров плазмы с подтвержденной ПЦР инфекцией SARS-CoV-2. Отрицательный контроль – 22 человека без симптомов, связанных с COVID-19, и без бытовых контактов с инфицированными пациентами.
Средний интервал между появлением симптомов и первым забором крови у 78 доноров составлял 60 дней (диапазон 22–112 дней). 28 доноров позже были протестированы снова, в среднем через 75 дней (24–154 дня) после появления симптомов. Средний интервал между двумя заборами крови составлял 25 дней (диапазон 10–61 день). Соотношение антител >1,1 считалось положительным, от ≥0,8 до <1,1 – пограничным, <0,8 - отрицательным. Результаты анализа на антитела:
- 13 из 78 (17%) доноров имели пограничные или отрицательные результаты (соотношение <1,1) анализа на антитела IgG к SARS-CoV-2.
- Повторное тестирование у 10 участников с соотношением <1,1 показало, что большинство результатов по антителам (9/10) остались схожими.
- У доноров с более высоким соотношением антител значения также остались на прежнем уровне.
- У 1 добровольца с пограничным отношением значение со временем увеличилось и стало положительным.
- У всех участников с соотношением антител <0,8 нейтрализующие антитела обнаружены не были.
Клеточный иммунитет определяли с 24 по 154 день после появления симптомов COVID-19 параллельно с тестированием на антитела. Ответ T-лимфоцитов определяли с помощью анализа IFN-γ ELISpot отдельно для каждого из различных стимулов: пептидных пулов белка S1 / S2, мембранного белка M и белкового антигена S1. Результаты анализа T-клеточного иммунитета:
- Ни один из ответов ELISpot существенно не отличался между 9 участниками с неопределяемыми ответами антител (соотношение <1,1) и 15 участниками с высокими ответами антител (соотношение >3).
- Ответы ELISpot на все стимулы у доноров были значительно выше, чем в группе отрицательного контроля.
- Сила ответов на белок S1 была выше в группе с соотношением антител >3, чем в группе с соотношением <1,1.
- Сила ответов на пептиды S1 / S2 была незначительно выше в группе с соотношением антител >3, чем в группе с соотношением <1,1, на пептид M - аналогично.
- Сила ответов на пептиды S1 / S2 в целом была выше, чем на белок S1 отдельно.
- Сила ответов T-клеток на стимулы в порядке возрастания: S1, S1 / S2, M. Такие ответы наблюдались как в группе с соотношением антител >3, так и в группе с соотношением <1,1.
- Доноры, у которых соотношение антител было <1,1, показали устойчивые ответы, направленные на белок M, тогда как пациенты с соотношением антител>3 имели устойчивые ответы на белки S1 / S2, S1 и M.
Выводы
У потенциальных доноров плазмы с неопределяемыми антителами против белка S1 SARS-CoV-2 ответ Т-клеток на мембранный белок M был сильнее, чем на белок S1. Возможно, Т-клетки этих доноров предпочтительно нацеливаются на пептиды, участвующие в сборке вирусных частиц, а не в связывании вируса с клеткой. Однако эта гипотеза нуждается в подтверждении.
Ответы на пептиды S1 / S2 были сильнее, чем на белок S1, возможно, потому, что фрагменты макромолекулы антигена S2 вызывали более сильный иммунный ответ.
Интересно, что различия между участниками с соотношением антител <1,1 и >3, по-видимому, более выражены после стимуляции белком S1, чем пептидами S1 / S2. Таким образом, помимо белка М, белок S2 может быть дополнительной мишенью для Т-клеточных ответов, особенно у участников с неопределяемыми Т- и В-клеточными ответами против белка S1.
Обнаружение того, что ответ Т-клеток на белок S1, который является наиболее специфичным для SARS-CoV-2, был относительно низким, поднимает вопрос о потенциальной перекрестной реактивности после стимуляции пептидами S1 / S2 или М.
Перекрестная реактивность ранее наблюдалась для антител к SARS-CoV-1 и SARS-CoV-2. Точно так же могут возникать перекрестно-реактивные к SARS-CoV-2 Т-клетки из-за контакта с распространенными коронавирусами. Это может повлиять на специфичность тестов ELISpot. Тем не менее, недавняя подтвержденная ПЦР инфекция SARS-CoV-2 могла привести к тому, что частота реактивных к SARS-CoV-2 Т-клеток была выше у потенциальных доноров плазмы, чем у тех, кто перенес другие распространенные коронавирусы. Кроме того, перекрестно-реактивные Т-клетки могут защищать от инфекции SARS-CoV-2, особенно детей и молодых людей с частыми социальными контактами. Исследование Braun et al. показало, что у 34% здоровых доноров плазмы есть ранее существовавшие SARS-CoV-2 S-перекрестно-реактивные CD4+ Т-клетки, а исследование Grifoni et al. обнаружило перекрестно-реактивные Т-клетки у 40% –60% лиц, не подвергавшихся воздействию коронавируса SARS-CoV-2. Однако из-за возможности того, что перекрестная реактивность мешает анализам ELISpot, ученые проверили Т-клеточные ответы в группе отрицательного контроля. Ответы были отрицательными.
Клеточный иммунитет к любому из антигенов SARS-CoV-2 был обнаружен у 7 из 9 (78%) участников, у которых соотношение антител было <1,1. Для сравнения, 12 из 15 (80%) участников с соотношением антител >3 имели определяемый клеточный иммунитет. Учитывая всех потенциальных доноров плазмы с подтвержденной ПЦР инфекцией SARS-CoV-2 (также с соотношением антител 1,1–3), 22 из 28 (79%) доноров имели T-клеточный иммунитет.
Таким образом, Т-клеточный иммунитет против SARS-CoV-2 наблюдался у большинства участников, положительных по ПЦР на SARS-CoV-2, с неопределяемыми антителами IgG к белку S1. В этой группе Т-клеточный иммунитет был сильнее направлен против белка М, чем против белка S1.
Защищает ли Т-клеточный иммунитет от повторного заражения коронавирусом
Отсутствие антител IgG к SARS-CoV-2 не означает, что человек не болел коронавирусом. Оценка клеточного иммунитета может дополнить данные о гуморальном ответе. Предыдущие исследования продемонстрировали, что величина ответа антител на SARS-CoV-2 зависит от продолжительности и силы воздействия вируса. Отсутствие устойчивых системных ответов IgG может указывать на легкую и временную инфекцию SARS-CoV-2, которая была эффективно устранена, например, врожденной иммунной системой. Однако необходимо выяснить, привел ли этот иммунный ответ к защитному иммунитету от коронавируса.
Chandrashekar et al. наблюдали почти полную защиту у 9 макак-резусов после инфекции SARS-CoV-2. После первоначального обезвреживания вируса при повторном заражении животные показали снижение средней вирусной нагрузки по сравнению с первичной инфекцией и устойчивый гуморальный и клеточный иммунный ответ. Deng et al. сообщили, что при повторном заражении SARS-CoV-2 у 4 макак-резусов наблюдалось временное повышение температуры тела, однако без вирусной нагрузки. Kirkcaldy et al. сообщили об ограниченных доказательствах повторного заражения среди перенесших COVID-19. Сингапурское исследование показало, что Т-клетки, специфичные для SARS-CoV-2, выявлялись у большинства выздоровевших пациентов. Данные о предыдущем коронавирусе SARS-CoV-1 показали, что клеточный иммунитет выявлялся в течение более 17 лет после заражения. Ученые Швеции и Франции наблюдали Т-клеточный ответ против SARS-CoV-2 у пациентов без антител к коронавирусу.
Данные IFN-γ ELISpot, полученные в среднем через 2 месяца после появления симптомов SARS-CoV-2, показывают, что 79% участников имели определяемый Т-клеточный иммунитет, что хорошо согласуется с предыдущими данными о структурно родственном коронавирусе SARS-CoV-1. Это означает, что у выздоравливающих пациентов с неопределяемым IgG к SARS-CoV-2 иммунитет могут обеспечивать Т-клетки.
Неоднородность иммунной памяти к SARS-CoV-2 и риск повторного заражения
Американские ученые исследовали иммунную память у 185 человек в возрасте от 18 до 81 года с бессимптомным, легким, умеренным и тяжелым COVID-19. У большинства пациентов был легкий случай COVID-19, не требующий госпитализации. 92% участников исследования никогда не были госпитализированы из-за COVID-19. 7% участников были госпитализированы, некоторым из них потребовалось лечение в отделении интенсивной терапии. Это соответствует распределению тяжести заболевания COVID-19 в США. Большинство участников (97%) сообщили о симптоматическом заболевании. Большинство участников сдали образец крови один раз между 6 и 240 днями после появления симптомов. 41 участник сдал образец крови более чем через 6 месяцев после появления симптомов. 38 участников предоставили 2-4 повторных образца крови в течение нескольких месяцев.
Особенности иммунной памяти к SARS-CoV-2:
- Титры циркулирующих антител в тяжелых случаях COVID-19 были выше, чем в легких случаях, что согласуется с данными других исследований.
- Не наблюдалось различий в B- и T-клеточной памяти между госпитализированными и не госпитализированными случаями COVID-19.
- В целом, у мужчин были более высокие уровни антител IgG против белка шипа (S), а также против нуклеокапсида (N) и RBD, чем у женщин. Более высокий уровень S IgG у мужчин также наблюдался в группе выздоравливающих.
- Напротив, не наблюдалось различий между мужчинами и женщинами в частотах B- и Т-клеток памяти к SARS-CoV-2.
Таким образом, неоднородность иммунной памяти к SARS-CoV-2 не связана с полом или тяжестью заболевания COVID-19.
Величина ответа антител против SARS-CoV-2 очень неоднородна у разных людей. Разнородные исходные реакции антител не сводятся в однородную циркулирующую память антител. Эта неоднородность является главной особенностью иммунной памяти к SARS-CoV-2. Для антител ответы охватывают ~ 200-кратный диапазон.
Источник неоднородности иммунной памяти к SARS-CoV-2 неизвестен и заслуживает дальнейшего изучения. Возможно, такая неоднородность является результатом низкой кумулятивной вирусной нагрузки, что приводит к очень незначительной или преходящей инфекции, которая вызывает слабый адаптивный иммунный ответ.
В результате неоднородности иммунного ответа можно ожидать, что, по крайней мере, часть переболевших SARS-CoV-2 с особенно низкой иммунной памятью будет относительно быстро восприимчива к повторному заражению.
Сколько держится иммунитет к коронавирусу после естественного течения заболевания?
Ученые предположили, что в защитном иммунитете важную роль играют 5 компонентов: RBD IgG, RBD IgA, RBD B-клетки памяти, SARS-CoV-2-специфические CD8+ и CD4+ Т-клетки.
Результаты исследования на 185 пациентах показали, что каждый компонент иммунной памяти к SARS-CoV-2 демонстрирует различную кинетику:
- Через 1-2 месяца после появления симптомов большинство (59%) случаев COVID-19 были положительными по всем пяти компонентам иммунной памяти.
- Были неполные иммунные ответы. У некоторых людей не обнаруживалась память CD8+ Т-клеток и / или был плохой ответ антител RBD IgA.
- К 5+ месяцам после COVID-19 доля людей, положительных по всем пяти компонентам иммунной памяти, упала до 40%. Однако 96% людей все еще были положительными по трем из пяти ответам иммунной памяти к SARS-CoV-2.
- Пиковые титры антител IgG были устойчивыми, с умеренным снижением через 6-8 месяцев после появления симптомов. Титры RBD IgG были потенциально одинаково стабильными.
- Через 5+ месяцев после появления симптомов почти все люди были положительными на антитела S и RBD IgG к SARS-CoV-2.
- B-клетки памяти, специфические для белка-шипа S или RBD, были обнаружены почти во всех случаях COVID-19, без видимого периода полувыведения через 5+ месяцев после заражения.
В-клеточная память о некоторых других инфекциях долговечна: 60+ лет после вакцинации против оспы, 90+ лет после заражения гриппом.
Период полураспада Т-клеток памяти, наблюдаемый в течение 6+ месяцев после появления симптомов в этом исследовании (~ 166 – 271 дней для CD8+ и ~ 96 – 174 дней для CD4+ Т-клеток), сопоставим с 123-дневным периодом полураспада для CD8+ T-клеток памяти после иммунизации против желтой лихорадки. Период полураспада CD4+ Т-клеток памяти к оспе – ~ 10 лет. Известен случай обнаружения Т-клетки к SARS-CoV через 17 лет после первоначального заражения. Эти данные показывают, что память Т-клеток может достигнуть более стабильного плато или более медленной фазы распада позже, чем в первые 6 месяцев после заражения.
Иммунная память, состоящая, по крайней мере, из трех иммунологических компонентов, была измерена у ~ 90% субъектов через ≥ 5 месяцев после появления симптомов. Это указывает на то, что устойчивый иммунитет против повторного COVID-19 возможен у большинства людей.
Сохраняется ли иммунитет к SARS-CoV-2 после COVID-19 в легкой форме?
Первая волна иммунного ответа – короткоживущие малоэффективные плазмобласты, секретирующие антитела. Далее организм генерирует высокоэффективные B-клетки памяти (MBC) и долгоживущие плазматические клетки (LLPC), секретирующие антитела. LLPC могут поддерживать определяемые титры сывороточных антител от месяцев до многих лет, в зависимости от конкретной вирусной инфекции. Очень важно отличать первую волну убывающих антител, производных от плазмобластов, от более поздней волны устойчивых антител, производных от LLPC, которые могут нейтрализовать последующие инфекции, потенциально на всю жизнь.
Популяции активированных клеток врожденного и адаптивного иммунитета увеличиваются в крови во время первичного ответа на инфекцию SARS-CoV-2. Когда острая вирусная инфекция проходит, большинство этих воспалительных клеток либо умирают, либо становятся клетками памяти.
Ученые Вашингтонского университета (Сиэтл, Вашингтон, США) оценили иммунные ответы у пациентов с легкой формой COVID-19 через один и три месяца после появления симптомов.
Чтобы определить, образуются ли клетки иммунной памяти после COVID-19 с легкими симптомами, ученые собрали плазму и мононуклеарные клетки периферической крови у 15 человек, вылечившихся от COVID-19. Первый образец крови был взят через ≥ 20 дней после положительного результата ПЦР-теста на SARS-CoV-2 и в среднем через 35,5 дней после появления симптомов. Вирусная нагрузка снижается примерно через 8 дней после появления симптомов, поэтому в этот момент времени будет сокращаться первичный иммунный ответ и формироваться ранняя иммунная память. Второй анализ крови собрали в среднем через 86 дней после появления симптомов, чтобы оценить количество и качество клеток иммунной памяти.
Исследование показало, что легкий COVID-19 индуцирует стойкие нейтрализующие антитела IgG к SARS-CoV-2. В течение, по крайней мере, 3 месяцев после появления симптомов у участников присутствовали LLPC, поддерживающие на обнаруживаемом уровне нейтрализующие антитела S и RBD IgG против SARS-CoV-2.
Инфекция SARS-CoV-2 индуцирует устойчивые функциональные S-реактивные CD4+ Т-клетки памяти. CD4+ Т-клетки памяти продуцируют цитокины в течение нескольких часов после активации, тогда как наивным Т-клеткам требуется несколько дней. CD4+ Т-клетки памяти, специфические для SARS-CoV-2, сохраняют способность оказывать помощь В-клеткам даже через три месяца после появления симптомов.
CD8+ Т-клетки памяти умеют убивать инфицированные вирусом клетки посредством направленной экспрессии цитокинов и молекул, разрушающих клетки. Как CD4+, так и CD8+ SARS-CoV-2-специфические Т-клетки памяти сохраняются и способны продуцировать эффекторные цитокины через три месяца после появления симптомов у пациентов с COVID-19 с легкими симптомами.
RBD-специфические B-клетки памяти, индуцированные инфекцией SARS-CoV-2, способны продуцировать нейтрализующие антитела против вируса и могут способствовать защите от повторного заражения SARS-CoV-2.
Исследование продемонстрировало повышенный уровень антител RBD IgG, которые образуются и сохраняются в течение как минимум 3 месяцев после заражения SARS-CoV-2.
Иммунная память к SARS-CoV-2 формируется и сохраняется после легкой формы COVID-19, по крайней мере, 3 месяца. Т-клетки памяти обладают признаками защитного противовирусного иммунитета. В то время как антитела выявляют вклад долгоживущих плазматических клеток (LLPC), функциональная вирус-специфическая память B- и T-лимфоцитов также может быть ключом к защитной иммунной памяти.
Иммунитет к SARS-CoV-2 при бессимптомной коронавирусной инфекции
Несмотря на способность бессимптомных людей, избавившихся от SARS-CoV-2, эффективно контролировать инфекцию, была выдвинута гипотеза о снижении у них противовирусного адаптивного иммунного ответа. Эта гипотеза подтверждается в основном измерениями специфических антител к SARS-CoV-2 и количества В-клеток.
Антитела и Т-клетки действуют вместе, чтобы уменьшить распространение вируса в организме и уничтожить патоген. Однако защитный иммунный ответ может также запускать патологические процессы, характеризующиеся локализованными или системными воспалительными реакциями. Воспаление и повреждение тканей могут быть результатом уничтожения инфицированных клеток вирус-специфическими антителами и Т-клетками или высвобождения медиаторов воспаления, продуцируемых инфицированными клетками и активированными миелоидными клетками. В тяжелых случаях системные высокие уровни воспалительных цитокинов и активированных моноцитов сосуществуют с вирус-специфическими антителами и Т-клетками. Таким образом, остается открытым вопрос о том, вызывают ли вирус-специфические антитела и Т-клетки преимущественно защиту или повреждение.
Эффективность вирус-специфических Т-клеток в устранении патогенов зависит от тонкого баланса между их противовирусными и воспалительными свойствами. Т-клетки, специфические для SARS-CoV-2, у людей, избавившихся от инфекции SARS-CoV-2 без симптомов, могут проявлять непатологические, но защитные характеристики.
Сингапурские ученые сравнили количество и функцию Т-лимфоцитов, специфических для SARS-CoV-2, в группе бессимптомных лиц (85 человек) и пациентов с симптомами COVID-19 (76 человек) в разные моменты времени после образования антител. Участники были отобраны среди рабочих, которые проживали в густонаселенных общежитиях и сдавали кровь при приеме на работу.
Ученые количественно оценили Т-клетки, реактивные к вирусным белкам: N (нуклеокапсид), S (белок-шип) и M (мембрана вируса), и измерили величину секреции цитокинов: IL-2, IFN-γ, IL-4, IL-6, IL-1β, TNF-α и IL-10 в цельной крови после активации Т-клеток SARS-CoV-2.
Исследование показало, что:
- На ранних этапах выздоровления частоты Т-лимфоцитов, специфических для различных белков SARS-CoV-2, были одинаковыми у бессимптомных и симптоматических лиц.
- Т-клетки, специфические для SARS-CoV-2, присутствуют у всех бессимптомных людей с антителами к коронавирусу.
- Частота Т-лимфоцитов, специфических для SARS-CoV-2, обнаруженная через 2-3 месяца после бессимптомной инфекции, была ниже, чем у пациентов с COVID-19 в аналогичное время после заражения, и идентична той, которая была обнаружена у выздоровевших от COVID-19 людей через 6 месяцев после заражения.
- У бессимптомных лиц наблюдались высокие уровни провоспалительных цитокинов IFN-γ и IL-2 и промежуточные уровни провоспалительных цитокинов IL-6, TNF-α, IL-1β и противовоспалительного цитокина IL-10. Напротив, у симптоматических лиц были низкие уровни IFN-γ и IL-2 и очень высокие уровни IL-6, TNF-α, IL-1β и IL-10.
Общая величина ответа Т-клеток против различных структурных белков одинакова как у бессимптомных лиц, так и у пациентов с COVID-19. Т-клетки, индуцированные бессимптомной инфекцией, по-видимому, секретируют большее количество IFN-γ и IL-2 и вызывают более скоординированное производство провоспалительных и регуляторных цитокинов, чем Т-клетки пациентов с симптомами COVID-19.
Таким образом, способность создавать значительный вирус-специфический Т-клеточный ответ не обязательно связана с серьезностью симптомов. Бессимптомные люди, инфицированные SARS-CoV-2, не характеризуются слабым противовирусным иммунитетом. Напротив, у них возникает устойчивый и высокофункциональный вирусоспецифический клеточный иммунный ответ, который защищает организм и не вызывает каких-либо явных патологий.
Первосточники
- Immunological memory to SARS-CoV-2 assessed for greater than six months after infection
- Functional SARS-CoV-2-sperific immune memory persists after mild COVID-19
- Highly functional virus-specific cellular immune response in asymptomatic SARS-CoV-2 infection
- Cellular Immunity in COVID-19 Convalescents with PCR-Confirmed Infection but with Undetectable SARS-CoV-2–Specific IgG
- Lessons in antiviral immunity